CRESCIMENTO
INFANTIL-JUVENIL: OS FATORES DE CRESCIMENTO SEMELHANTES À INSULINA-IGFS CIRCULAM
LIGADOS A PROTEÍNAS DE LIGAÇÃO DO FATOR DE CRESCIMENTO -IGFBPS, SEIS DOS QUAIS
FORAM IDENTIFICADAS. A IGFBP-3 É A PRINCIPAL IGFBP CIRCULANTE DURANTE A VIDA
PÓS-NATAL E É GH-DEPENDENTE
Ao longo dos últimos anos, muitos
estudos têm sido efetuados, a fim de esclarecer o mecanismo pelo qual as
influências de deficiência de insulina em pacientes com DM1, alteram a estatura
longitudinal final nestes pacientes. O crescimento ósseo longitudinal é um
fenômeno complexo envolvendo uma multiplicidade de mecanismos de regulação
fortemente influenciados pelo hormônio de crescimento-GH. O hormônio de
crescimento-GH tem uma secreção pulsátil com idade-dependente concentrações
caracterizada por baixa secreção no pré-período da puberdade, o aumento na
puberdade e uma diminuição na velhice. A maioria dos efeitos que o hormônio de
crescimento-GH promove é mediada através das ações de peptídeos, do fator de
crescimento semelhante à insulina-IGF-I e IGF-II, principalmente secretados
pelo fígado. Os fatores de crescimento semelhantes à insulina-IGFs circulam
ligados a proteínas de ligação do fator de crescimento -IGFBPs, seis dos quais
foram identificadas. A IGFBP-3 é a principal IGFBP circulante durante a vida
pós-natal e é GH-dependente. A IGFBP-3 prolonga a meia-vida do IGF e carrega
IGFs para os tecidos alvo fazendo um complexo ternário com subunidade ácido
lábil-ALS, tendo assim um papel crítico na regulação do crescimento
esquelético. A insulina é um regulador importante do presente complexo. De
fato, a secreção adequada de insulina e concentrações normais de insulina é
necessária para apoiar concentrações séricas normais de IGF e IGFBP e
indiretamente promover o crescimento. Vários estudos têm claramente demonstrado
que a insulina modula eventos de expressão do receptor hepático de GH e
receptores pós-hepáticos de forma a influenciar as concentrações séricas do IGF
e IGFBP. Além disso, modula a expressão do gene da insulina e a secreção de
IGFBP-1, um dos mais importantes reguladores negativos de bioatividade do
IGF-I. A deficiência de insulina portal é, portanto, diretamente responsável
pela hipersecreção de GH, níveis baixos de circulação de IGF-I e IGFBP-3, e
altos níveis circulantes de IGFBP-1 observados em crianças com DM1
independentemente da puberdade, e representa uma das causas mais importantes de
falta de crescimento em DM1.
As concentrações portal de insulina
desempenham um papel crítico na indução de GH e da resistência à insulina
relatada nas crianças com DM1. Em estudos “in vitro” indicam que a insulina
pode indiretamente regular a o valor da concentração do GH sérico ou pela
regulação direta do receptor hepático de GH ou por um efeito permissivo sobre o
pós-eventos de receptor. Estudos “in vivo” demonstraram alterações nas
concentrações de proteína de ligação de GH no soro, que são consideradas um
índice de número putativo receptor de GH. Estudos em pacientes
recém-diagnosticados com DM1 demonstraram uma diminuição na circulação de
concentrações de proteína de ligação de GH, que, posteriormente, aumentam com a
introdução da terapêutica insulínica, embora os níveis permaneçam inferiores
aos relatados em indivíduos normais. A baixa expressão do receptor de GH e
anomalias em eventos pós-receptorial induzem a hipersecreção de GH, amplamente
relatados em crianças com DM1, que é a mais clara expressão da resistência ao GH
em crianças com DM1. Anormalidades no eixo GH-IGF-I e, especialmente
concentrações séricas elevadas de GH pode ser considerado um dos fatores mais
relevantes na resistência à insulina detectada em crianças com DM1. Resultados
relevantes para clarificar a resistência à insulina-dependente de GH foram
relatados em ratinhos híbridos, resultando em fígado com deficiência de IGF-1e
ação antagonista de GH-GHA. Alguns autores demonstraram que a inativação da
ação de GH leva à diminuição de níveis de glicose no sangue, também informou
que ambos os níveis de glicose no sangue e concentrações de insulina no soro em
jejum em camundongos com GHA são drasticamente reduzidos em comparação com o
controle e camundongos expressando apenas a falta de ação do GH. Além disso, o
teste de tolerância à insulina mostrou um estado da insensibilidade à insulina
em ratos tampa que é detectado em TAMPA þ camundongos GHA, demonstrando que a
falta de ação de GH pode melhorar a sensibilidade periférica à insulina, assim,
subjacente o principal papel dos altos níveis de GH crônicos em resistência à
insulina em pacientes com DM1.
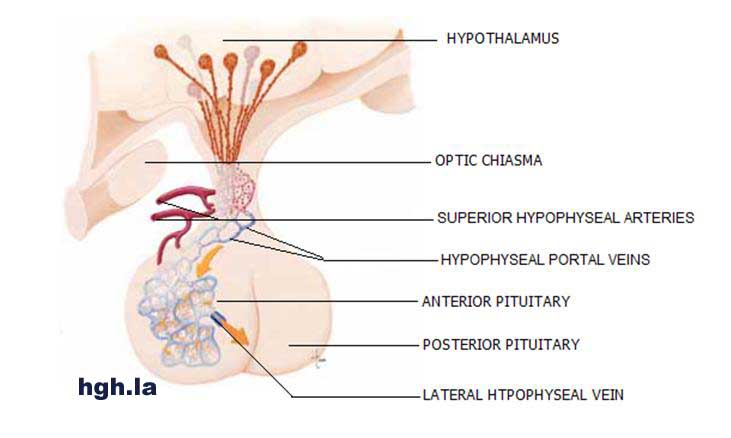
Os aumentos foram amplamente
informados em concentrações de GH basal, a frequência de pulso e amplitude de
GH em pacientes com diabetes têm profundos efeitos anti-insulina semelhante à
de indivíduos saudáveis, resultando em aumento. As concentrações de glicose no
sangue associadas com a diminuição da sensibilidade periférica à insulina,
apesar de níveis mais altos de secreção de insulina, o aumento da produção de glicose
hepática, a estimulação da lipólise e a diminuição de insulina-estimulada pela
captação de glicose no músculo. Em indivíduos saudáveis o GH exógeno
administrado em níveis fisiológicos provoca resistência à insulina, por
prejudicar a capacidade da insulina para suprimir a utilização da glicose
hepática. Este efeito é caracterizado por reduzida afinidade hiperglicêmica de
ligação ao receptor da insulina, assim como um provável defeito de
pós-receptor. Assim, o desenvolvimento da resistência à insulina em indivíduos
com a função das células beta normal está associado com um aumento
compensatório na secreção de insulina, que permite a continuação da manutenção
da tolerância à glicose normal. Em indivíduos com DM1, efeitos semelhantes
foram demonstrados pelo aumento da necessidade de insulina durante os estudos.
De fato, usando uma taxa variável de insulina durante a noite em infusão de protocolos de manutenção euglicêmicos, alguns autores têm demonstrado uma relação positiva entre sensibilidade periférica à insulina e as concentrações de GH durante a noite atribuível ao efeito do GH sobre o metabolismo da glicose periférica. De fato, uma correlação linear positiva a variações nas concentrações séricas de GH tem sido descrita. Os níveis aumentados de GH resultam em hiperglicemia septicemia hemorrágica viral que conduz ao aumento da noite para o dia das necessidades de insulina característicos do “fenômeno dawn”. Embora muitos estudos têm sido realizados para esclarecer as ligações entre GH e a hipersecreção e sensibilidade periférica à insulina em DM1, o mecanismo molecular ainda não foi esclarecido.
De fato, usando uma taxa variável de insulina durante a noite em infusão de protocolos de manutenção euglicêmicos, alguns autores têm demonstrado uma relação positiva entre sensibilidade periférica à insulina e as concentrações de GH durante a noite atribuível ao efeito do GH sobre o metabolismo da glicose periférica. De fato, uma correlação linear positiva a variações nas concentrações séricas de GH tem sido descrita. Os níveis aumentados de GH resultam em hiperglicemia septicemia hemorrágica viral que conduz ao aumento da noite para o dia das necessidades de insulina característicos do “fenômeno dawn”. Embora muitos estudos têm sido realizados para esclarecer as ligações entre GH e a hipersecreção e sensibilidade periférica à insulina em DM1, o mecanismo molecular ainda não foi esclarecido.
ativa o Ras-Raf-MAP-cinase (MAPK) via de sinalização. O GH pode ativar a p90 RSK, Quinase S6, o mais provável através de MAPK. Além disso, alguns estudos mostraram que o GH pode promover a fosforilação da tirosina do substrato IR-1 (IRS-1) e IRS-2 proteínas por ativação de JAK2. Outro mecanismo que pode estar envolvido na diminuição da sensibilidade da insulina GH-dependente é o aumento das concentrações de supressores de sinalização de citocinas (SOCS). De fato, tanto interações para indução de insulina do IRS-1 e p85-MAPK e ativação AKT parece ser afetada pela expressão de SOCS-1, -3 e -6. Além disso, tem se demonstrado que SOCS-1 e -3 pode ligar-se a IRS-1e -2 e promover a sua degradação. Recentes estudos realizados em ratos SOCS-1-deficiente demonstrar uma prolongada IRS-1 fosforilação seguinte ao tratamento com insulina, que resulta em um estado avançado de sensibilidade à insulina. Em contraste, a drástica diminuição de IRS-1 e -2 níveis induzidos pela expressão do adenovírus conduzido de SOCS-1 no fígado de ratos resultando no surgimento de hiperglicemia, hiperinsulinemia e resistência à insulina. Evidência de que agora existe anomalias na secreção de GH e alterações específicas de tecidos com biodisponibilidade de IGF podem estar envolvidos em muitas das complicações relacionadas ao diabetes. A prevenção de curto e longo prazo das anormalidades do eixo GH-IGF-I em DM1 é importante no desenvolvimento de modalidades terapêuticas visando não só melhorar o controle metabólico, mas também na prevenção das complicações vasculares associadas com DM1.
Portanto, vários estudos com GH DNA-recombinante exógeno humano (rh)
IGF-I, em associação com a insulinoterapia foram realizados. Exógena rhIGF-1.
Como saber mais:
1. As ações e interações dos sistemas endócrino e nervoso, por meio das quais o sistema nervoso regula o sistema endócrino e a atividade endócrina modula a atividade do sistema nervoso central, constituem os principais mecanismos reguladores de praticamente todas as atividades fisiológicas...
http://hormoniocrescimentoadultos.blogspot.com.
2. Células nervosas e células endócrinas, ambas envolvidas na comunicação entre as células, compartilham certas características-secreção de mensageiros químicos (neurotransmissores ou hormônios) e atividades elétricas...
http://longevidadefutura.blogspot.com
3. Um mensageiro químico isolado-peptídeo ou amina-pode ser secretado por neurônios como um neurotransmissor ou por hormônio neural e por células endócrinas como um hormônio clássico...
http://imcobesidade.blogspot.com
AUTORIZADO O USO DOS DIREITOS AUTORAIS COM CITAÇÃO
DOS AUTORES PROSPECTIVOS ET REFERÊNCIA BIBLIOGRÁFICA.
Referências Bibliográficas:
Dr. João Santos Caio Jr, Endocrinologista, Neuroendocrinologista, Dra Henriqueta Verlangieri Caio, Endocrinologista, medicina interna – Van Der Häägen Brazil, São Paulo, Brasil; Salardi S, S Tonioli, Tassoni P, Tellarini M, L & Mazzanti Cacciari E. Crescimento e fatores de crescimento em diabetes Mellitus. Archives of Doenças na Infância 1987 62 57-62;
Penfold J, Chase HP, Marshall G, Walravens CF, Walravens PA & Garg SK.
Altura adulta final e sua relação com a glicose no sangue controle e
complicações microvasculares em IDDM. Diabetic Medicine 1995 12 129-133;
Donaghue KC, Kordonouri O, Chan A & M. Silink Secular tendências no
crescimento em diabetes: estamos ganhando? Arquivos de Doenças na Infância 2003
88 151-154; Kember NF. Cinética das células e o controlo do crescimento de
ossos longos. Cinética tecido celular 1978 11 477-485; Kember NF. Cinética das
células e o controlo do crescimento do osso. Acta Paediatrica 1993 82 (Suppl
391) 61-65; Salmão WD Jr & Daughaday WH. Um soro hormonalmente controlado
fator que estimula a incorporação de sulfato de cartilagem in vitro. Jornal de
Laboratório e Clínica 1957 49 825-836; Salmon WD Jr & Daughaday WH. Um soro
hormonalmente controlado fator que estimula a incorporação de sulfato de
cartilagem in vitro. Jornal de Laboratório e Clínica 1990 116 408-419; Jones JI
& Clemmons DR. Fatores de crescimento semelhante à insulina e sua proteínas
de ligação: ações biológicas. Endocrine Comentários 1995 163-34; Blum W &
Ranke MB. Fator de crescimento semelhante à insulina proteínas de ligação
(IGFBPs), com especial referência a IGFBP-3. Acta Paediatrica Scandinavica 1990
(Suppl 367) 55-62; Francesco Chiarelli, Cosimo Giannini e Angelika Mohn
Departamento de Pediatria da Universidade de Chieti, Itália.
1987 62 57-62;
Penfold J, Chase HP, Marshall G, Walravens CF, Walravens PA & Garg SK.
Altura adulta final e sua relação com a glicose no sangue controle e
complicações microvasculares em IDDM. Diabetic Medicine 1995 12 129-133;
Donaghue KC, Kordonouri O, Chan A & M. Silink Secular tendências no
crescimento em diabetes: estamos ganhando? Arquivos de Doenças na Infância 2003
88 151-154; Kember NF. Cinética das células e o controlo do crescimento de
ossos longos. Cinética tecido celular 1978 11 477-485; Kember NF. Cinética das
células e o controlo do crescimento do osso. Acta Paediatrica 1993 82 (Suppl
391) 61-65; Salmão WD Jr & Daughaday WH. Um soro hormonalmente controlado
fator que estimula a incorporação de sulfato de cartilagem in vitro. Jornal de
Laboratório e Clínica 1957 49 825-836; Salmon WD Jr & Daughaday WH. Um soro
hormonalmente controlado fator que estimula a incorporação de sulfato de
cartilagem in vitro. Jornal de Laboratório e Clínica 1990 116 408-419; Jones JI
& Clemmons DR. Fatores de crescimento semelhante à insulina e sua proteínas
de ligação: ações biológicas. Endocrine Comentários 1995 163-34; Blum W &
Ranke MB. Fator de crescimento semelhante à insulina proteínas de ligação
(IGFBPs), com especial referência a IGFBP-3. Acta Paediatrica Scandinavica 1990
(Suppl 367) 55-62; Francesco Chiarelli, Cosimo Giannini e Angelika Mohn
Departamento de Pediatria da Universidade de Chieti, Itália.
Dr. João Santos Caio Jr.
Endocrinologia – Neuroendocrinologista
CRM 20611
Dra. Henriqueta V. Caio
Endocrinologista – Medicina Interna
CRM 28930
Como saber mais:
1. As ações e interações dos sistemas endócrino e nervoso, por meio das quais o sistema nervoso regula o sistema endócrino e a atividade endócrina modula a atividade do sistema nervoso central, constituem os principais mecanismos reguladores de praticamente todas as atividades fisiológicas...
http://hormoniocrescimentoadultos.blogspot.com.
2. Células nervosas e células endócrinas, ambas envolvidas na comunicação entre as células, compartilham certas características-secreção de mensageiros químicos (neurotransmissores ou hormônios) e atividades elétricas...
http://longevidadefutura.blogspot.com
3. Um mensageiro químico isolado-peptídeo ou amina-pode ser secretado por neurônios como um neurotransmissor ou por hormônio neural e por células endócrinas como um hormônio clássico...
http://imcobesidade.blogspot.com
AUTORIZADO O USO DOS DIREITOS AUTORAIS COM CITAÇÃO
DOS AUTORES PROSPECTIVOS ET REFERÊNCIA BIBLIOGRÁFICA.
Referências Bibliográficas:
Dr. João Santos Caio Jr, Endocrinologista, Neuroendocrinologista, Dra Henriqueta Verlangieri Caio, Endocrinologista, medicina interna – Van Der Häägen Brazil, São Paulo, Brasil; Salardi S, S Tonioli, Tassoni P, Tellarini M, L & Mazzanti Cacciari E. Crescimento e fatores de crescimento em diabetes Mellitus. Archives of Doenças na Infância
Site Van Der Häägen Brazil
www.vanderhaagenbrazil.com.br http://drcaiojr.site.med.br
http://dracaio.site.med.br
Video
http://youtu.be/woonaiFJQwY
CONTATO:
Fones: 55(11) 5572-4848 (11)2371-3337 - (11)9.8197-4706 - TIM
Fones: 55(11) 5572-4848 (11)2371-3337 - (11)9.8197-4706 - TIM
Rua Estela, 515 - Bloco D - 12º andar - Conj 121/122
Paraiso - São Paulo - SP - Cep 04011-002
e-mail: vandergaagenbrasil@gmail.com
Paraiso - São Paulo - SP - Cep 04011-002
e-mail: vandergaagenbrasil@gmail.com



